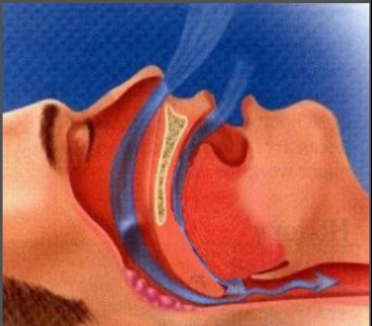
Apnéia Obstrutiva do Sono (AOS) é uma doença crônica progressiva caracterizada pela completa interrupção do fluxo aéreo durante o sono por, no mínimo, dez segundos, associada a esforços respiratórios com movimentos tóraco-abdominais e sensação de falta de ar. A interrupção do fluxo aéreo decorre de um colapso das vias aéreas superiores durante a respiração como resultado de uma pressão intraluminal negativa produzida pela contração diafragmática, que é maior que a força produzida pelos músculos dilatadores da orofaringe. O colapso das vias aéreas pode ser agravado durante o sono pela posteriorização da língua durante a posição supina ao dormir, que diminui ainda mais a luz do espaço aéreo, e pela tentativa de superar a obstrução com o esforço respiratório, que aumenta a pressão de sucção.
Com o bloqueio do fluxo aéreo, há uma queda na saturação de oxigênio de, no mínimo, 4% dentro de um período de 30 segundos, além do aumento da concentração sangüínea de dióxido de carbono, ou hipercapnia, e acidose. Esta desencadeia um estímulo central causando um despertar breve não necessariamente consciente, que leva à uma abertura da orofaringe e à volta da respiração. Com a volta do sono, os músculos da orofaringe relaxam e o processo reinicia, podendo se repetir centenas de vezes durante a noite.
O índice de Apnéia-Hipopnéia (IAH), definido como o número total de episódios de apnéia e de hipopnéia por hora de sono, é maior que cinco nos pacientes que sofrem da síndrome da AOS. Cada episódio é, usualmente, acompanhado por um microdespertar eletroencefalográficoe o conjunto destes acontecimentos danifica a estrutura do sono, ao aumentar o tempo de sono superficial em detrimento dos estágios mais profundos. O ronco barulhento é um sintoma característico dessa síndrome e é causado pela vibração dos tecidos moles da orofaringe principalmente durante a inspiração46. Nos pacientes com a AOS ocorre um ciclo intermitente, caracterizado por uma seqüência de roncos, um silêncio respiratório (apnéia ou hipopnéia) e, por fim, uma força expiratória explosiva que pode estar acompanhada de uma vocalização e um despertar breve.
A AOS tem vários graus de manifestação e pode ser classificada como suave, moderada, severa, de acordo com o IAH e nível de saturação de oxigênio (SaO2) conforme a Tabela 1.
Tabela 1 – Grau de severidade da AOS de acordo com o IAH.
SEVERIDADE da AOS IAH (eventos/h):
Suave- 5 a 14,9
Moderada- 15 a 29,9
Severa- > 30
A AOS acomete, principalmente, indivíduos de 30 a 60 anos de idadee com índice de massa corporal (IMC) variando entre 26 a 33 kg/mii . Sabe-se que 2/3 dos indivíduos apnéicos são obesos, com peso 20% acima do ideal15, uma vez que o depósito de gordura intensifica o estreitamento do lúmen da faringe.
A AOS é uma doença de alta prevalência, mas o risco varia de acordo com a idade, sexo, hábitos e fatores antropométricos. Acomete aproximadamente 4% dos adultos6, ocorrendo 6 a 7 vezes mais em homens que em mulheres. Cerca de 1 a 2% do total da população de cidades industrializadas é afetada contribuindo para um aumento substancial das taxas de mortalidadeiii e morbidade cardiovascular. Aproximadamente 1 a 3% das crianças apresentam a doença, porém com episódios mais curtos e mais freqüentes de apnéia.
ETIOLOGIA da apneia e ronco
Vários fatores etiológicos associados à AOS podem estar presentes de forma isolada ou não, mesmo que alguns ainda não estejam bem esclarecidos.
Qualquer fator que contribua para a instabilidade da ventilação respiratória afeta o controle da passagem aérea superior durante o sono. A falta de sincronia no controle motor da atividade dos músculos do peito e do diafragma resulta em uma ampla flutuação do calibre das vias aéreas superiores, que interfere na passagem de ar e pode causar obstrução.
Outros fatores também podem conduzir à AOS, como a obesidade, a história familiar de AOS, as técnicas ortodôntico-cirúrgicas impróprias tal como o recuo mandibular cirúrgico em um paciente classe III portador apenas de uma deficiência da maxila, e a postura supina ao dormir.
Uma das causas mais freqüentes da AOS consiste na obstrução do fluxo nasal que pode ser decorrente tanto de reações alérgicas e infecciosas quanto de polipose nasal, angiofibroma, hipertrofia do corneto inferiorou estreitamento coanal posterior.
A hipertrofia adenotonsilar a tonsilite, a presença de tecidos adenoideanos hipertrofiados, a retrusão lingual e orofaríngea, e o excessivo volume da língua, úvula e palato mole são fatores que levam à obstrução do fluxo orofaríngeo predispondo à AOS. A hipertrofia adenotonsilar é a causa mais comum de AOS em crianças, apesar de outros fatores anatômicos poderem estar associados.
Um fenótipo que pode contribuir para a obstrução da passagem aérea superior desencadeando a presença concomitante da AOS está freqüentemente presente nas deformidades dentofaciais, tais como deformidade orbital severa, retrognatia e hipoplasia maxilar e principalmente mandibular, bem como na acondroplasia, na microssomia hemifacial12 e nas Síndromes de Down, Crouzon24, Prader-Willy15, Treacher Collins24, Pierre Robin24,35, e no quadro clínico encontrado na translocação do cromossomo dezoito35.
Múltiplas anormalidades fisiológicas e anatômicas são responsáveis pela AOS em 31 a 63% dos pacientes com Síndrome de Down30. Um aumento das infecções das vias aéreas superiores com aumento das secreções mucosas e drenagem nasal crônica levam à hiperplasia tonsilar e adenoideana30, que, ao ser acompanhada de hipoplasia maxilar24 ou mandibular, é responsável pela relativa aglomeração das estruturas da face média30. Devido à pequena dimensão das cavidades oral e nasal, a língua, apesar de ter um frequente volume normal, parece relativamente aumentada. Além disso, a hipotonia muscular generalizada desses pacientes pode contribuir para agravar o quadro30.
Durante o exame clínico de um paciente sob suspeita de AOS deve-se dar atenção a todos os fatores etiológicos que predispõem ou contribuem para o desenvolvimento da enfermidade. Cabe também questionar durante a anamnese se o paciente tem como hábitos consumir álcool ou medicamentos sedativos ou relaxantes antes de dormir, pois ao provocarem um relaxamento dos músculos da faringe podem desencadear apnéia em roncadores benignos ou, naqueles com AOS, aumentar a duração e a freqüência dos episódios apnéicos46.
EXAMES COMPLEMENTARES
Os exames complementares normalmente indicados incluem uma telerradiografia lateral e uma polissonografia noturna, que por sua vez é a única que poderá confirmar o diagnóstico. A análise cefalométrica pode auxiliar nessa avaliação revelando o grau de uma possível micrognatia ou retrognatia, além de possibilitar a mensuração do espaço aéreo posterior. A polissonografia é um exame que consiste em um registro de múltiplas variáveis obtidas durante uma noite inteira em que o paciente dorme no laboratório do sono. O registro permitirá avaliar o tipo, a freqüência e duração das apnéias e/ou hipopnéias, as características do ronco, o grau
de dessaturação de oxigênio, as arritmias cardíacas, a fragmentação do sono, os movimentos da musculatura tóraco-abdominal, os movimentos oculares e a severidade do quadro clínico encontrado46.
COMPLICAÇÕES DA AOS
Os apnéicos obstrutivos podem apresentar sonolência diurna15,22,37,40,42, sono inquieto12,42, hipertensão diurna15,22,37,40,42, disritmia noturna, hipertensão pulmonar, falha dos ventrículos direito e esquerdo e infarto do miocárdio55.
A excessiva sonolência diurna conseqüente à AOS provoca significativos déficits neuropsicológicos, dentre eles redução da habilidade psicomotora e do desempenho sexual, e déficits cognitivos, como a perda de memória e a redução da vigilância e do discernimento. Isso tem maior influência em termos da qualidade de vida individual, porém também causa um impacto econômico-social no que se refere ao decréscimo da eficiência, absenteísmo e potencial para acidentes de trânsito e ocupacionais4,17,32.
Em crianças, a AOS pode manifestar algumas seqüelas como distúrbios de comportamento24, retardo mental, deficiência de crescimento24, episódios de gagueira, cefaléia matinal e queda no rendimento escolar12,13,30,33. Estes sintomas são amplificados em crianças com deformidades craniofaciais12.
Adultos apnéicos e crianças com AOS severa podem apresentar hipertensão sistêmica6,25,26,35,54 como complicação comum. A ocorrência de cada apnéia desencadeia a liberação de catecolaminas e a ativação do sistema nervoso simpático, além de acarretar hipoxemia26,43 e mudanças no rendimento cardíaco35. Com o aumento da atividade simpática, há uma elevação da pressão arterial, que é maior ao longo do dia que durante o sono35,54. A hipertensão está intimamente relacionada à severidade da AOS35.
A hipertensão pulmonar26,43 também é uma potencial complicação da AOS com uma prevalência de 15 a 20%50. A hipóxia é a maior determinante nas mudanças da pressão arterial pulmonar durante a apnéia50. Outras complicações pulmonares e cardiovasculares4,12,33,36 incluem a “cor pulmonale” 12,24,43, a insuficiência pulmonar e cardiovascular12,35,41, a perda de variação circadiana25,35, as arritmias25,26,43 e as disritmias, presentes quando a saturação de oxigênio é menor que 72%15. Essas circunstâncias aumentam o risco de acidente vascular cerebral e infarto do miocárdio4,25, que levam a um aumento da mortalidade15.
TRATAMENTO
De acordo com o grau de severidade da doença, a terapia pode ser conservadora ou cirúrgica12. Esta é indicada quando a terapia conservadora foi ineficaz ou não foi bem tolerada pelo paciente ou quando há uma anormalidade, passível de correção cirúrgica, causando a AOS44.
Terapias Conservadoras:
– Postura ao dormir
Alteração na postura ao dormir pode melhorar a respiração de pacientes com distúrbios do sono38. O decúbito lateral reduz a tendência da língua em recair posteriormente e obstruir a faringe. Um mecanismo similar ocorre com a elevação da cabeça e tronco durante o sono. A elevação do corpo em 30 graus durante o sono reduz o colapso das vias aéreas superiores por modificar o vetor gravitacional sobre a língua e o palato mole37.
– Redução do Índice de Massa Corporal
A redução do IMC de pacientes obesos está indicada como tratamento de AOS de grau suave, apesar do mecanismo exato da melhora ainda não ser bem conhecido12,13,22,3338. Este programa de perda de peso envolve uma dieta pouco calórica
associada à modificação de hábitos do paciente, sendo de uma forma mais rigorosa nos pacientes com IMC ≥ 30 Kg/m2 22,33.
– Medicamentos
Medicamentos podem ser utilizados para reduzir o IAH de pacientes com AOS, como a cafeína e a teofilina. Já a metilfenidatina diminui a sensação de sonolência diurna provocada pelos eventos apnéicos, e os esteróides orais e intranasais são prescritos mais apropriadamente em casos de pólipo nasal43.
– Aparelhos intrabucais
Os aparelhos intrabucais têm seu design derivado dos aparelhos funcionais34 usados para a correção da classe II, e vários têm sido propostos e usados como tratamento do ronco e AOS. Eles são mais efetivos nos pacientes com apnéia suave a moderada1,31,32,49 e existem três principais tipos de aparelhos, quando avaliados sob a perspectiva de seu tipo de ação. O primeiro deles é o reposicionador de língua, que traciona a língua através de um dispositivo de sucção e a mantém em uma posição anteriorizada, longe da parede posterior da faringe. Com isso, há um aumento do espaço aéreo posterior e diminuição da resistência à passagem de ar9,19,48. É um dispositivo eficaz e que pode ser utilizado em pacientes edentados, já que não necessita de dentes na boca para sua ancoragem. O segundo tipo de aparelho intrabucal é menos relatado na literatura e provoca o levantamento do palato mole e da úvula21, com o objetivo de diminuir a vibração do palato mole, a responsável pelo som do ronco31. O terceiro tipo de aparelho é o mais utilizado e reposiciona a mandíbula e a base da língua anteriormente, o que aumenta o espaço aéreo superior3,18,32.
O aparelho intrabucal reposicionador da mandíbula possui uma ancoragem quase que exclusivamente dentária48. Usualmente ele possui uma abertura na região anterior para manter livre a passagem aérea48. Dependendo do seu design, o dispositivo pode32 ou não permitir movimentos de lateralidade, protrusão e de abertura bucal31.
O uso de um aparelho pode ocasionar efeitos colaterais e complicações como lábios e orofaringe secos, aumento da salivação, leve sensibilidade nos dentes na fase de adaptação do paciente ou por um pequeno intervalo de tempo após acordar, além de alterações no fechamento da mordida, por 15 a 30 minutos imediatamente após a remoção do aparelho1,8,31,32,48,49. O uso desses dispositivos por mais de dois anos pode também causar inclinações dentárias, mordida aberta posterior e protração dos dentes inferiores, apesar de não ocorrer alteração na postura mandibular48.
Podem-se minimizar os efeitos dentários utilizando-se uma cobertura de acrílico sobre as superfícies oclusais para produzir uma maior distribuição de estresse na estrutura periodontal, e assim diminuir a movimentação dentária indesejada48. Mas, a maior preocupação é com o grande avanço da mandíbula durante horas por noite, que pode ocasionar distensão das estruturas orofaciais, tensão muscular e dor na região da ATM1,31,49, que tendem a desaparecer com a descontinuidade do tratamento11. Já alterações significativas na morfologia da ATM não foram observadas com o uso do aparelho1.
A quantidade de avanço mandibular parece ser crucial no efeito dos aparelhos intrabucais sobre o IAH1,29,31, pois quanto maior o avanço mandibular mais efetivo o aparelho45. Normalmente a mandíbula é avançada em 50 a 80% de sua máxima protrusão7,52, e o limite de avanço individual é evidenciado pelo desconforto, que deve ser respeitado45. O desempenho clínico dos aparelhos reposicionadores da mandíbula também depende de características do paciente, sendo mais efetivos em pacientes mais novos, com baixo IMC, maxila grande no sentido ântero-posterior, pequena sobressaliência e menor orofaringe32,48. Estudos mostram que o aparelho reposicionador da mandíbula tem efeito significativo sobre o ronco,
sonolência diurna, qualidade do sono, episódios de apnéia, dessaturação de oxigênio e movimentos corporais durante o sono1,31,32.
Um aparelho ideal deve produzir uma mínima quantidade de deslocamento mandibular necessário para diminuir o ronco e a apnéia, não deve ter efeito sobre o espaço da língua, produzir mínimo dano aos dentes e ao periodonto, ter vida útil longa, não ter efeito adverso sobre a oclusão, ATM e sistema mastigatório após alguns anos de tratamento31. Portanto, os aparelhos reposicionadores da mandíbula não devem ser indicados para pacientes que possuem menos de 10 dentes hígidos em cada arcada, com doença periodontal severa ou disfunção da ATM49.
As vantagens dos aparelhos intrabucais são relativa simplicidade do tratamento e sua reversibilidade, boa tolerância pelos pacientes por ser uma técnica não invasiva, boas eficiência e razão custo-benefício, e o fato de ser uma alternativa de tratamento para pacientes que rejeitam ou são intolerantes ao CPAP (Continuous Positive Airway Pressure)ou com grande risco cirúrgico1,31,32.
Vale ressaltar que antes do início da terapia com aparelhos intrabucais, a AOS e o ronco devem ser diagnosticados através de uma polissonografia para identificar os riscos dos pacientes bem como para analisar os estados iniciais dos problemas antes do uso do aparelho, e obter parâmetros para posterior comparação de dados e avaliação do efeito do tratamento1,2.
– Máscara de ventilação nasal
No que se refere aos procedimentos conservadores, o CPAP é o mais utilizado22,25,32,40,46. Este consiste em um tubo, uma máscara nasal e um pequeno compressor, que injeta ar pela via nasal do paciente a fim de abrir mecanicamente as vias aéreas durante o sono. O CPAP é o tratamento de escolha para pacientes cooperativos43 e obesos41,51 com AOS moderada à severa27 e sem congestão nasal37. Da mesma forma, é usado quando há insucessos cirúrgicos15 no tratamento da AOS, risco aumentado por complicações anestésicas em cirurgias26,43 e no caso de delírio agudo, confusão aguda e agitação psicomotora proporcionada pela hipoxemia e pela fragmentação do sono40. É um tratamento seguro que resulta em importantes benefícios para pacientes com AOS por eliminar os eventos apnéicos24,41 e as dessaturações de oxigênio noturnas24, além de reduzir a hipertensão arterial27. Cerca de 20 a 30% dos pacientes rejeitam o CPAP, usualmente durante as primeiras duas a quatro semanas de uso. As queixas mais comuns são pressão nasal e/ou sinusal, flatulência e desconforto peitoral, resultado do aumento da pressão pelo volume aumentado do pulmão durante a terapia27.
O BIPAP26,43 (Bilevel Positive Pressure Airway) e o IPPV (Intermittent Positive-Pressure Ventilation) também são opções de tratamento com indicações semelhantes às do CPAP devido ao funcionamento similar.
Terapias cirúrgicas:
Quando a AOS é suave, terapias cirúrgicas convencionais podem se fazer necessárias, incluindo adenotonsilectomia13,22,24,35, uvulopalatofaringoplastia convencional (UPFP)13,15,16,25,26,41, ou a laser (Laser Assisted Uvula Palatoplasty, LAUP)15 e alívio da obstrução nasal15,37 através de procedimentos como septorrinoplastia26, cornetoplastia e abertura da estenose coanal12,13,24,43.
A cirurgia ortognática para avanço da maxila e/ou da mandíbula é uma alternativa de tratamento para pacientes portadores de deficiência ântero-posterior da maxila e, especialmente, da mandíbula. Com a cirurgia, há um reposicionamento anterior dos tecidos faríngeos inseridos à maxila, e/ou à mandíbula e hióide. Isso promove um aumento do espaço aéreo posterior. A cirurgia ortognática é um tratamento que tem se mostrado estável e efetivo no tratamento da AOS, com redução significativa dos sintomas22,44.
Nos casos extremos de AOS muito severa em pacientes com anormalidades cranio-faciais26,43, inflexibilidade da coluna cervical26, pacientes não-cooperativos a outras terapias43, pacientes que não obtiveram sucesso em cirurgias para AOS e recém-nascidos com AOS associada a anomalias generalizadas como as cardiotorácicas, a traqueotomia se faz necessária, sendo o tratamento de última escolha13,24.
REFERÊNCIAS BIBLIOGRÁFICAS
1. ALMEIDA, F.R. de et al. Effects of mandibular posture on obstructive sleep apnea severity and the temporomandibular joint in patients fitted with an oral appliance. Sleep, New York, v. 25, n. 5, p. 507-513, aug. 2002.
2. American Sleep Disorders Association. Practice parameters for the treatment of snoring and obstructive sleep apnea with oral appliances. Sleep, New York, v. 18, n. 6 , p. 511-513, july 1995.
3. ATHANASIOU, A. E. et al. Cephalometric evaluation of pharynx, soft palate, adenoid tissue, tongue, and hyoid bone following the use of a mandibular repositioning appliance in obstructive sleep apnea patients. Int J Adult Orthod Orthognat Surg, Chicago, v. 9, n. 4, p. 273-283, 1994.
4. BAUMEL, M. J.; MAISLIN, G.; PACK, A. I. Population and occupational screening for obstructive sleep apnea: are we there yet? Am J Respir Crit Care Med, New York, v. 155, n. 1, p. 9-14, jan. 1997.
5. BENNETT, L. S. et al. Sleep fragmentation indices as predictors of daytime sleepiness and nCPAP response in obstructive sleep apnea. Am J Respir Crit Care Med, New York, v. 158, n. 3, p. 778-786, sept. 1998.
6. BIXLER, E. O. et al. Effects of age on sleep apnea in men: prevalence and severity. Am J Respir Crit Care Med, New York, v. 157, n. 1, p. 144-148, jan. 1998.
7. BONDEMARK, L. Does 2 years’ nocturnal treatment with a mandibular advancement splint in adult patients with snoring and OSAS cause a change in the posture of the mandible? Am J Orthod Dentofacial Orthop, St. Louis, v. 116, n. 6, p. 621-628, dec. 1999.
8. BONDEMARK, L.; LINDMAN, R. Craniomandibular status and function in patients with habitual snoring and obstructive sleep apnoea after nocturnal treatment with a mandibular advancement splint: a 2-year follow-up. Eur J Orthod, London, v. 22, n. 1, p. 53-60, feb. 2000.
9. CARTWRIGHT, R. D.; SAMELSON, C. The effects of a non-surgical treatment for obstructive sleep apnea: the tongue retaining device. JAMA, Chicago v. 248, n. 6, p. 705-709, aug. 1982.
10. CHAOUAT, A. et al. Association of chronic obstructive pulmonary disease and sleep apnoea syndrome. Am J Respir Crit Care Med, New York, v. 15, n. 1, p. 182-186, jan. 1995.
11. CLARK, G. et al. Effect of anterior mandibular positioning on obstructive sleep apnea. Am Rev Respir Dis, Baltimore, v. 147, n. 3, p. 624-629, mar. 1993.
12. COHEN, S. R. et al. Airway disorders in Hemifacial Microssomia. Plast Reconstr Surg, Baltimore, v. 103, n. 1, p. 27-33, jan. 1999.
13. COHEN, S. R., SIMMS, C.; BURSTEIN, F. D. Mandibular distraction osteogenesis in the treatment of upper airway obstruction in children with craniofacial deformities. Plast Reconstr Surg, Baltimore, v. 101, n. 2, p. 312-318, feb. 1998.
14. DOUGLAS, N. J. Sleep in patients with chronic obstructive pulmonary disease. Clin Chest Med, Philadelphia, v. 19, n. 1, p. 115-125, mar. 1998.
15. DUNLEVY, T. M.; KARAKLA, D. W. Uvulopalatopharyngoplasty: The Naval Medical Center, Portsmouth, experience. Am J Otolaryngol, Cherry Hill, v. 19, n. 3, p. 174-177, may-june 1998.
16. ELASFOUR, A. et al. Evaluation of uvulopalatopharyngoplasty in treatment of obstructive sleep apnea syndrome. Acta Otolaryngol Stockholm, v. 537, suppl., p. 52-56, 1998.
17. FINDLEY, L. J.; UNVERZAGT, M. E.; SURATT, P. N. Automobile accidents involving patients with obstructive sleep apnea. Am Rev Respir Dis, Baltimore, v. 138, n. 2, p. 337-340, aug. 1988.
18. GALE, D. et al. Do oral appliances enlarge the airway in patients with obstructive sleep apnoea? A prospective computerized tomographic study. Eur J Orthod, London, v. 22, n. 2, p. 159-168, apr. 2000.
19. GAVISH, A. et al. Cephalometric and polysomnographic analyses of functional magnetic system therapy in patients with obstructive sleep apnea. Am J Orthod Dentofacial Orthop, St. Louis, v. 120, n. 2, p. 169-177, aug. 2001.
20. GUILLEMINAULT, C; STOHS, R. Chronic snoring and obstructive sleep apnea syndrome in children. Lung, Heidelberg, v. 168, suppl., p. 912-919, 1990.
21. HAZE, J. J. Treatment of obstructive sleep apnea with the equalizer appliance. J N J Dent Assoc, v. 58, n. 1, p. 34-36, winter 1987.
22. HOCHBAN, W. et al. Surgical maxillofacial treatment of obstructive sleep apnea. Plast Reconstr Surg, Baltimore, v. 99, n. 3, p. 619-628, mar. 1997.
23. HUDGEL, D. W. et al. Instability of ventilatory control in patients with obstructive sleep apnea. Am J Respir Crit Care Med, New York, v. 158, n. 4, p. 1142-1149, oct. 1998.
24. HUI, S. et al. Obstructive sleep apnea syndrome in a family with Crouzon’s syndrome. Sleep, New York, v. 21, n. 1, p. 298-303, may 1998.
25. JAGER, L. et al. Fluoroscopic MR of the pharynx in patients with obstructive sleep apnea. AJNR Am J Neuroradiol, Baltimore, v. 19, n. 7, p. 1205-1214, aug. 1998.
26. JOHNSON, J. T.; BRAUN, T. W. Preoperative, intraoperative, and postoperative management of patients with obstructive sleep apnea syndrome. Otolaryngol Clin North Am, Philadelphia, v. 31, n. 6, p. 1025-1030, dec. 1998.
27. JOKIC, R. et al. Continuous positive airway pressure requirement during the first month of treatment in patients with severe obstructive sleep apnea. Chest, Chicago, v. 114, n. 4, p. 1061-1069, oct. 1998.
28. KUNA, S. T.; SMICKLEY, J. S. Superior pharyngeal constrictor activation in obstructive sleep apnea. Am J Respir Crit Care Med, New York, v. 156, n. 3, p. 874-880, sept. 1997.
29. LAVIGNE, G. J. et al. Sleep disorders and the dental patient: an overview. Oral Surg Oral Med Oral Pathol Oral Radiol Endod, St. Louis, v. 88, n. 3, p. 257-272, sept. 1999. Review.
30. LEFAIVRE, J. F. et al. Down syndrome: identification and surgical management of obstructive sleep apnea. Plast Reconstr Surg, Baltimore, v. 99, n. 3, p. 629-637, mar. 1997.
31. LINDMAN, R.; BONDMARK, L. A review of oral devices in treatment of habitual snoring and obstructive sleep apnoea. Swed Dent J, Jönköping, v. 25, n. 1, p. 39-51, 2001. Review.
32. LIU, Y. et al. Cephalometric and physiologic predictors of the efficacy of an adjustable oral appliance for treating obstructive sleep apnea. Am J Orthod Dentofacial Orthop, St. Louis, v. 120, n. 6, p. 639-647, dec. 2001.
33. LOJANDER, J. et al. A nurse-managed weight reduction programme for obstructive sleep apnoea syndrome. J Intern Med, v. 244, n. 3, p. 251-255, sept. 1998.
34. LOWE, A. A. Dental appliances for the treatment of snoring and obstructive sleep apnea. In: Kryger M, Roth T, Demente W, editors. Principles and practice of sleep medicine. 3rd ed. Philadelphia: WB Saunders; 2000. p. 929-939.
35. MARCUS, C. L.; GREENE, M. G.; CARROLL, J. L. Blood pressure in children with obstructive sleep apnea. Am J Respir Crit Care Med, New York, v. 157, n. 4, p. 1098-1103, apr. 1998.
36. MARKLUND, M. et al. The effect of a mandibular advancement device on apneas and sleep in patients with obstructive sleep apnea. Chest, Chicago, v. 113, n. 3, p. 707-713, mar. 1998.
37. MIYAZAKI, S. et al. Influence of nasal obstruction on obstructive sleep apnea. Acta Otolaryngol, Stockholm, v. 537, suppl., p. 43-46, 1998.
38. MOHSENIN, N.; MOSTOFI, M. T.; MOHSENIN, V. The role of oral appliances in treating obstructive sleep apnea. J Am Dent Assoc, Chicago, v. 134, n. 4, p. 442- 449, apr. 2003.
39. MORRELL, M. J. et al. Progressive retropalatal narrowing preceding obstructive apnea. Am J Respir Crit Care Med, New York, v. 158, n. 6, p. 1974-1981, dec. 1998.
40. MUÑOZ, X. et al. Acute delirium as a manifestation of obstructive sleep apnea syndrome. Am J Respir Crit Care Med, New York, v. 158, n. 4, p. 1306-1307, oct. 1998.
41. NEIL, A. M. et al. Effects of sleep posture on upper airway stability in patients with obstructive sleep apnea. Am J Respir Crit Care Med, New York, v. 155, n. 1, p. 199-204, jan. 1997.
42. NIEMINEN, P. et al. Snoring children: factors predicting sleep apnea. Acta Otolaryngol, Stockholm, v. 529, suppl., p. 190-194, 1997.
43. POSTIC, W. P.; SHAH, U. K. Nonsurgical and surgical management of infants and children with obstructive sleep apnea syndrome. Otolaryngol Clin North Am, Philadelphia, v. 31, n. 6, p. 969-977, dec. 1998.
44. PRINSELL, J. R. Maxillomandibular advancement surgery for obstructive sleep apnea syndrome. J Am Dent Assoc, Chicago, v. 133, n. 11, p. 1489-1497, nov. 2002.
45. RAPHAELSON, M. A. et al. Oral appliance therapy for obstructive sleep apnea syndrom: progressive mandibular advancement during polisomnography. Cranio, Chattanooga, v. 16, n. 1, p. 44-50, jan. 1998. Review.
46. REIMÃO, R. Sono: Estudo abrangente. 2 ed. São Paulo: Editora Atheneu, 1996.
47. REMMERS, J. E. et al. Pathogenesis of upper airway occlusion during sleep. J Appl Physiol, Washington, v. 44, n. 6, p. 931-938, june 1978.
48. ROSE, E. C. et al. Occlusal and skeletal effects of an oral appliance in the treatment of obstructive sleep apnea. Chest, Chicago, v. 122, n. 3, p. 871-877, sept. 2002.
49. ROSE, E. C. et al. Therapeutic efficacy of an oral appliance in the treatment of obstructive sleep apnea: a 2-year follow-up. Am J Orthod Dentofacial Orthop, St. Louis, v. 121, n. 3, p. 273-279, mar. 2002.
50. SCHAFER, H. et al. Pulmonary haemodynamics in obstructive sleep apnoea: time course and associated factors. Eur Respir J, Copenhagen, v. 12, n. 3, p. 679-684, sept. 1998.
51. SCHECHTER, G. L. et al. Nasal patency and the effectiveness of nasal continuous positive air pressure in obstructive sleep apnea. Otolaryngol Head Neck Surg, St. Louis, v. 118, n. 5, p. 643-647, may 1998.
52. THORNTON, W. K.; ROBERTS, D. H. Nonsurgical management of the obstructive sleep apnea patient. J Oral Maxillofac Surg, Philadelphia, v. 54, n. 9, p.1103-1108, sept. 1996.
53. TIIHONEN, M.; PARTINEN, M. Polysomnography and maintenance of wakefulness test as predictors of CPAP effectiveness in obstructive sleep apnea. Electroencephalogr Clin Neurophysiol, Amsterdam, v. 107, n. 6, p. 383-386, dec. 1998.
54. WORSNOP, C. J. et al. The prevalence of obstructive sleep apnea in hypertensives. Am J Respir Crit Care Med, New York, v. 157, n. 1, p. 111-115, jan. 1998.
55. YAMASHIRO, Y.; KRYGER, M. H. Why should sleep apnea be diagnosed and treated? Clin Pulm Med, sl, v. 4, p. 250-259, 1994.